Белки — это строительные блоки жизни, сложные молекулы, выполняющие бесчисленное множество функций в нашем организме. Они рождаются на рибосомах, словно из мастерских клеточных фабрик, где генетический код преобразуется в цепочки аминокислот. Но этот процесс — лишь первый акт. Как опытный кузнец, придающий форму заготовке, клетка модифицирует эти молодые белки с помощью специальных ферментов, помогая им обрести свою окончательную структуру и функциональность.
NAC: Небольшой Комплекс, Огромное Влияние
Долгое время оставался загадкой механизм взаимодействия этих ферментов и то, как их активность координируется в густонаселенном мире рибосомы. Но теперь международная команда ученых из Калифорнийского технологического института, Университета Констанца и ETH Zurich пролила свет на этот сложный танец молекул. Оказалось, что главным дирижером этого оркестра является относительно небольшой белковый комплекс — NAC (nascent polypeptide-associated complex).
Представьте NAC как незаметного помощника, всегда присутствующего в рибосомном туннеле, где рождаются новые белки. Он словно опытный наставник, направляющий молодых белковых молекул по верному пути, обеспечивая их правильную модификацию и сборку.
Без NAC клетка погружается в хаос: белки неправильно сворачиваются, теряют свою функциональность и могут даже оказаться в неверных местах. Это может привести к активации стрессовых реакций и нарушению жизненно важных процессов.
Механизм Двойного Преображения
“NAC — это настоящий многофункциональный инструмент, участвующий во множестве процессов. Было сложно понять, как такой небольшой белковый комплекс может оказывать такое всеобъемлющее влияние”, — говорит профессор Шу-Оу Шан из Калифорнийского технологического института, один из авторов этой важной работы.
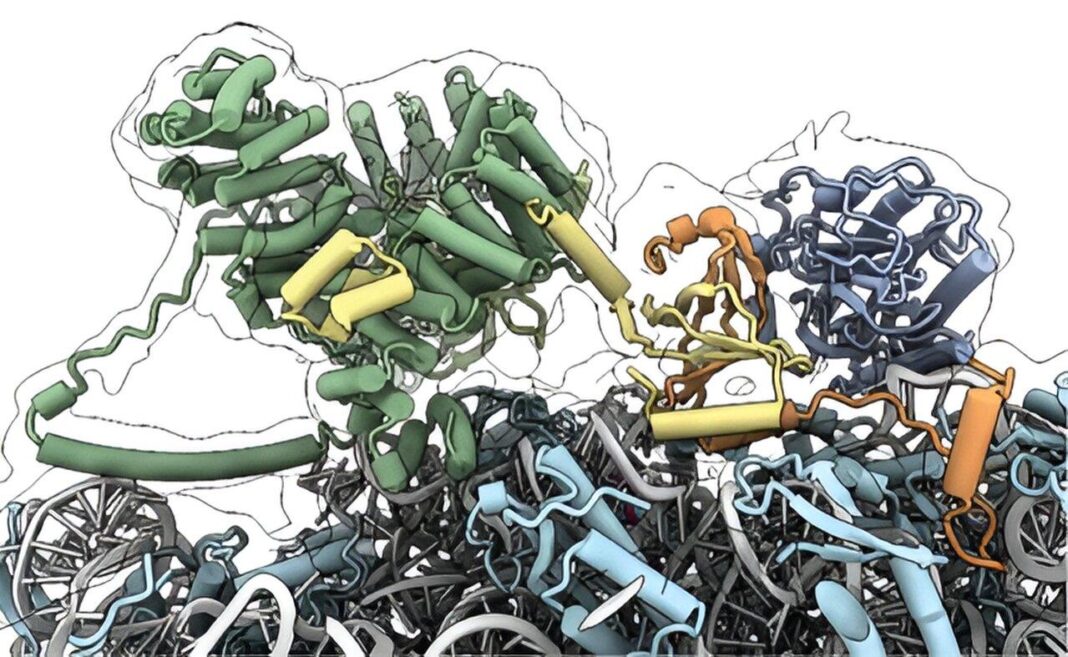
Исследователи сосредоточились на двух ключевых модификациях, которые NAC координирует: удалении первой аминокислоты — метионина — с растущего белка и последующем присоединении ацетильной группы к оставшемуся концу. Эти процессы происходят непосредственно после выхода белка из рибосомного туннеля, в тот самый момент, когда он покидает фабрику рибосомы.
Эти модификации — словно ключи, открывающие двери к полноценной функциональности для большинства наших белков. Они влияют на их трехмерную структуру, срок службы и взаимодействие с другими белками, определяя тем самым правильное функционирование всего организма.
Когда NAC Не Работает: Последствия для Здоровья
Любое сбои в системе модификации белков под руководством NAC может иметь катастрофические последствия. Это может привести к нарушениям развития или стать причиной серьезных заболеваний, таких как рак и болезнь Паркинсона.
Разгадка Танца Ферментов
Механизм, управляемый NAC, поражает своей точностью. В считанные доли секунды после выхода белка из рибосомы должны быть активированы и правильно позиционированы два фермента: MetAP1 (для удаления метионина) и NatA (для ацетилирования). Но NatA обычно находится в спящем режиме, связанный с ингибирующим белком HYPK.
Ученые из Калифорнийского технологического института и их коллеги провели целую серию биохимических, структурных и in vivo экспериментов, чтобы разгадать эту молекулярную головоломку. Они обнаружили, что NAC действует как мастер-регулятор, размещая MetAP1 и NatA в нужном месте рядом с выходом из рибосомного туннеля, обеспечивая доступ к зарождающемуся белку.
Более того, NAC освобождает NatA от ингибирующего контакта с HYPK, активируя его только в точке назначения — рибосоме. Это гарантирует, что ацетилирование происходит точно вовремя и в нужном месте.
Ключевым инструментом в этой исследовательской работе стали разработанные лабораторией Шана флуоресцентные метки, встроенные в зарождающийся белок рибосомы. Именно они позволили наблюдать взаимодействие и привлечение ферментов NAC к процессу.
NAC: Еще Больше, Чем Мы Думали
Ранее было уже установлено, что NAC привлекает в рибосомный туннель не только MetAP1 и NatA, но и другие важные компоненты. Это открывает перспективу на еще более сложную роль NAC — как центра молекулярного контроля, который обеспечивает доступ молодым белкам к необходимым инструментам для правильной сборки и функционирования.
“Мы предполагаем, что NAC действует как настоящий координатор, гарантируя, чтобы зарождающиеся белки получали нужные им “инструменты” в нужное время и в нужном месте, в зависимости от их специфических потребностей”, — говорит Мартин Гамердингер, соавтор статьи из Университета Констанца.
Это исследование проливает свет на одну из важных страниц этой молекулярной драмы. Понимание того, как NAC управляет модификацией белков, открывает новые пути для разработки терапевтических подходов к заболеваниям, вызванным сбоями в этом процессе.